
高壓氧治療的作用機制:獲FDA 及 UHMS 批核適應症的專科分類深度解析
高壓氧治療 (Hyperbaric Oxygen Therapy, HBOT) 是一種在超過大氣壓力的密閉環境中吸入純氧的醫療技術,已獲美國食品藥物管理局 (FDA) 及美國水下與高壓醫學協會 (UHMS) 批准用於多項醫療適應症。本文將深入探討高壓氧治療的分子機制,並按醫學專科分類其臨床應用。
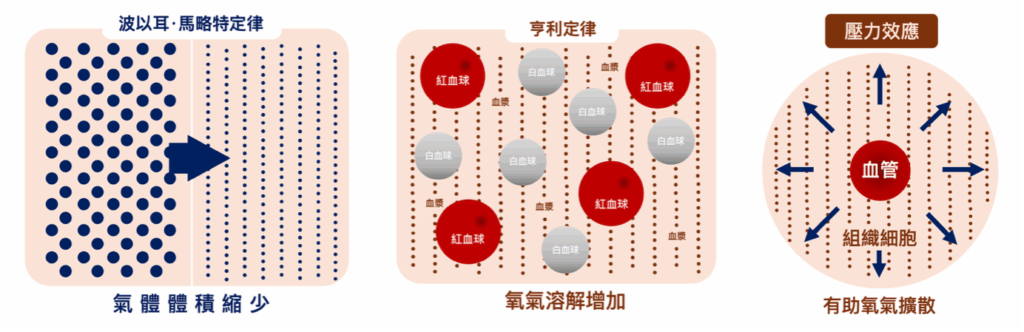
高壓氧治療的基本物理原理
Henry定律與Boyle定律的應用
- Henry定律:在增壓環境下,血漿中溶解的氧氣濃度會隨壓力增加而提升。在3大氣壓絶對壓力 (3 ATA) 下吸入100%純氧,動脈氧分壓可達2000mmHg,組織氧分壓達500mmHg,使血漿攜氧量達到6mL O₂/dL,足以在不依賴血紅蛋白的情況下維持細胞代謝需求。
- Boyle定律:隨著壓力增加,氣體體積會縮小。這一原理對治療減壓症及氣體栓塞症尤為重要,在3ATA壓力下,氣泡體積可縮小三分之一。
高壓氧治療的分子作用機制
細胞層面的生理效應
- 高氧化作用與細胞代謝
HBOT增加血漿及組織中的溶解氧濃度,根據Henry定律,在3 ATA下血氧含量從正常16.2 mL O₂/dL增加至23.0 mL O₂/dL,提升42%,這一增加主要來自血漿中溶解氧的提升。氧氣主要用於ATP合成,平均每分升血液需要6 mL氧氣維持細胞代謝,而HBOT提供的血漿氧足以單獨維持細胞呼吸,甚至可應對嚴重失血性貧血。
- 活性氧物質 (ROS) 與活性氮物質 (RNS) 的產生
HBOT會在細胞內產生活性氧物質 (包括超氧陰離子O₂⁻、過氧化氫H₂O₂、羥基自由基OH) 和活性氮物質。這些分子既具有抗菌效應,也能作為信號分子調節多種生理過程。
血管系統效應
- 血管收縮與微循環調節
HBOT引起健康血管的全身性血管收縮,主要機制是內皮細胞一氧化氮 (NO) 產生減少。高氧環境加速NO自由基氧化,削弱其血管舒張效應。儘管血管收縮暫時減少血流,但血漿高氧狀態補償了這一影響,實際上改善了缺血組織的微血管血流。
- 血管新生與內皮祖細胞動員
HBOT刺激血管內皮生長因子 (VEGF)、血小板衍生生長因子 (PDGF) 及纖維母細胞生長因子 (FGF) 的產生。這些生長因子通過一氧化氮調節部分介導,促進毛細血管萌芽和傷口肉芽化。此外,HBOT還能動員骨髓源性幹細胞/祖細胞,主要是CD34⁺ 細胞,通過一氧化氮依賴機制促進血管再生。
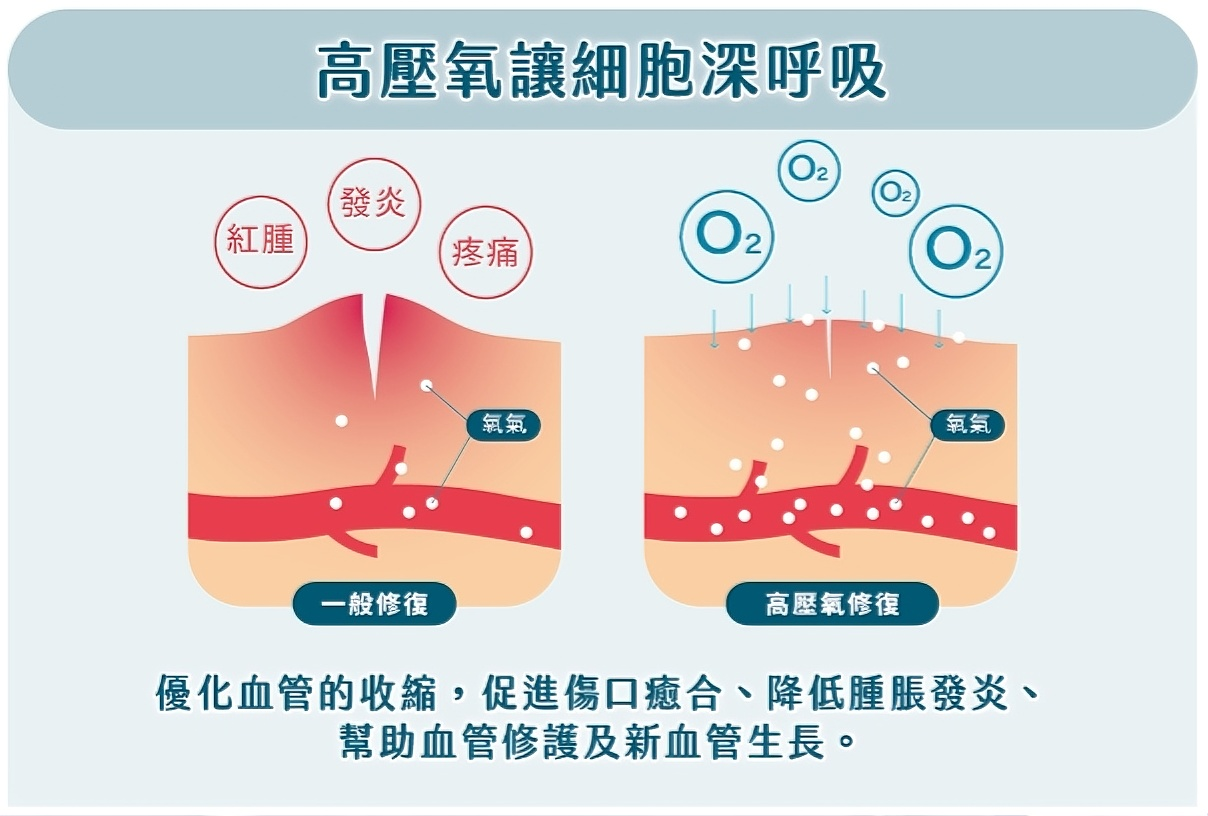
膠原蛋白合成與組織修復
HBOT顯著促進膠原蛋白III的形成。研究顯示,在糖尿病足潰瘍模型中,HBOT組的膠原蛋白III體積分數比對照組高約120%,而膠原蛋白I和III在傷口中的總比例較健康皮膚高65%。這表明HBOT加速了組織修復過程中的膠原蛋白合成。
抗菌與免疫調節機制
- 中性粒細胞氧化殺菌作用增強
HBOT增強中性粒細胞的呼吸爆發殺菌機制。研究表明,HBOT提高了中性粒細胞對金黃色葡萄球菌的殺菌能力。氧氣被中性粒細胞和巨噬細胞利用產生過氧化氫、超氧陰離子、氯化氫和羥基自由基,這些活性氧物質通過膜破壞和蛋白質變性殺滅細菌。
- 生物膜滲透與抗生素協同效應
HBOT使氧氣在細菌生物膜中的滲透增加四倍,提高細菌的代謝活性和生長速度,使其對抗生素治療更加敏感。同時,HBOT與多種抗生素具有協同效應,增強抗菌治療效果。
神經保護機制
- 抗凋亡與神經營養效應
HBOT通過LC3II和Bcl-2途徑直接預防細胞凋亡,同時下調caspase介導的細胞凋亡並增強自噬。在創傷性腦損傷模型中,HBOT顯著降低了參與細胞死亡的基因活性,並在傷後幾天內增加了抗凋亡基因和神經營養因子的活性。
- 神經炎症調節
HBOT能抑制TLR4/NF-κB信號通路,減少TNF-α、IL-1β和IL-6的表達,降低神/經凋亡並改善神經功能。此外,HBOT還能增加血腦屏障周圍組織中血紅素氧化酶、Nrf2和醌氧化還原酶1的表達,改善創傷性腦損傷後的神經功能。
FDA及UHMS核准的臨床適應症 (專科分類)
急症醫學科
- 減壓症 (潛水醫學):根據Boyle定律,HBOT壓縮氣泡並促進氮氣通過擴散從氣泡中置換出來,有效治療快速上升導致的血流中氣體栓塞。
- 動脈氣體栓塞:HBOT是動脈氣體栓塞的一線治療方法,通過壓縮氣泡體積和改善循環來逆轉局部缺氧。
- 一氧化碳中毒:HBOT通過質量作用定律減少一氧化碳從血紅蛋白解離的半衰期。在常壓空氣條件下,羧基血紅蛋白的半衰期為4-6小時,而在3 ATA下吸入100%氧氣可將半衰期縮短至23分鐘。
- 嚴重貧血 (無法輸血時):HBOT提供的血漿氧足以維持細胞呼吸,在無法輸血的嚴重貧血患者中可作為救命治療。
感染科與外科
- 壞死性筋膜炎:HBOT增強中性粒細胞的氧化殺菌作用,並與抗生素具有協同效應,對抗嚴重的軟組織感染。
- 氣性壞疽 (梭狀芽孢桿菌感染):HBOT通過毒素抑制機制和增強宿主防禦能力,有效治療這種威脅生命的感染。
- 顱內膿腫:在手術禁忌的情況下,HBOT可作為輔助治療,通過增強免疫細胞功能和抗生素效果來控制感染。
- 頑固性骨髓炎:HBOT促進骨組織血管新生和膠原蛋白合成,同時增強抗生素在骨組織中的效果。
皮膚科與整形外科
- 糖尿病足潰瘍等難癒合傷口:HBOT通過促進血管新生、膠原蛋白合成和上皮化來改善慢性傷口癒合。研究顯示HBOT顯著增加膠原蛋白III的形成,促進傷口修復。
- 嚴重燒傷:HBOT減少組織水腫並促進皮膚移植的成活率,同時加速燒傷組織的修復過程。
- 皮瓣或移植物血流不良:HBOT的獨特機制可能包括關閉動靜脈分流,改善受損皮瓣的血液供應。
腫瘤科 (放射治療後遺症)
延遲性放射損傷:HBOT促進受放射損傷組織的血管新生和膠原蛋白合成,修復放射治療造成的軟組織和骨骼壞死。放射治療後組織的血管內皮受損和微血管密度下降,HBOT通過刺激VEGF和其他生長因子表達來促進新血管形成。
眼科
中央視網膜動脈阻塞 (CRAO):HBOT提高視網膜組織氧分壓,在血流恢復前維持神經元存活,減少不可逆的視力損失。
耳鼻喉科
突發性感音神經性聽力損失:HBOT可能通過改善內耳血液循環和減少氧化應激來促進聽力恢復。
創傷外科與骨科
擠壓傷和腔室症候群:HBOT減少缺血再灌注損傷,降低中性粒細胞對內皮的黏附,並減少脂質過氧化,保護受創傷組織免受進一步損傷。
治療參數與安全考量
HBOT的標準治療壓力範圍為2.0-3.0 ATA (202.65-303.975 kPa),每次治療時間60-120分鐘。大多數適應症需要連續數週的每日治療,通常為4-8週。FDA建議在經UHMS認證的高壓氧設施接受治療,以確保安全性和臨床適宜性。
未來研究方向
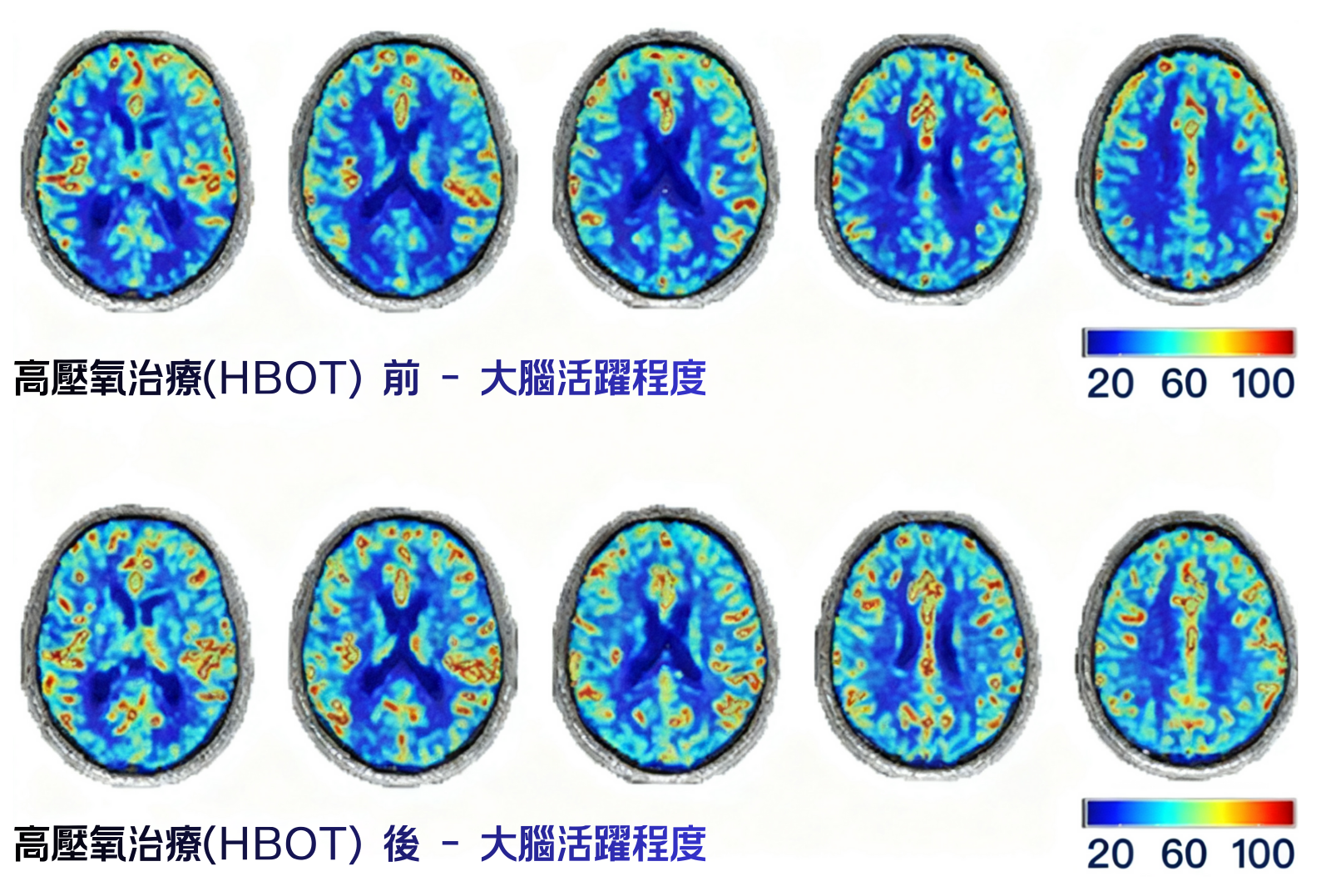
當前研究正在探索HBOT在創傷性腦損傷、中風後神經功能恢復等領域的應用。蛋白質組學分析顯示,HBOT影響氧轉運活性、氧結合和T細胞增殖調節等多個通路,為擴大其臨床應用提供了分子基礎。
總結
高壓氧治療通過多重分子機制發揮治療效果,包括增加組織氧合、促進血管新生、增強免疫功能、促進膠原蛋白合成和提供神經保護。其在FDA和UHMS批准的適應症中涵蓋了急症醫學、感染科、皮膚科、腫瘤科、眼科等多個專科,為患者提供了安全有效的輔助治療選擇。隨著對其分子機制理解的深入,HBOT的臨床應用範圍有望進一步擴大。
資料來源:
- https://www.health.harvard.edu/staying-healthy/hyperbaric-oxygen-therapy-evidence-based-uses-and-unproven-claims
- https://utswmed.org/medblog/hyperbaric-oxygen-therapy/
- https://www.uhms.org/images/indications/UHMS%20Indications%2015th%20Ed%20Front%20Matter%20and%20References.pdf
- https://health.mil/Reference-Center/Publications/2025/07/25/Hyperbaric-Oxygen-Therapy-and-TBI
- https://cupola.gettysburg.edu/cgi/viewcontent.cgi?article=2015&context=student_scholarship
- Hyperbaric Physiological And Pharmacological Effects of Gases – Adam C. Kahle; Jeffrey S. Cooper. – https://www.ncbi.nlm.nih.gov/books/NBK470481/
- Survey of Molecular Mechanisms of Hyperbaric Oxygen in Tissue Repair – Joerg Lindenmann, Christian Smolle, Lars-Peter Kamolz, Freyja Maria Smolle-Juettner, Wolfgang F Graier – https://pmc.ncbi.nlm.nih.gov/articles/PMC8584249/
- https://pmc.ncbi.nlm.nih.gov/articles/PMC3058327/
- https://www.frontiersin.org/journals/cellular-and-infection-microbiology/articles/10.3389/fcimb.2022.805964/full
- https://pmc.ncbi.nlm.nih.gov/articles/PMC8920905/
- https://www.ncbi.nlm.nih.gov/books/NBK482231/
- Hyperbaric oxygen: its uses, mechanisms of action and outcomes – A.L. Gill, C.N.A. Bell – QJM: An International Journal of Medicine, Volume 97, Issue 7, July 2004, Pages 385–395, https://doi.org/10.1093/qjmed/hch074
- https://journalofsportsmedicine.org/full-text/746/eng
- https://pmc.ncbi.nlm.nih.gov/articles/PMC8820531/
- Thom SR. Hyperbaric oxygen: its mechanisms and efficacy. Plast Reconstr Surg. 2011;127 Suppl 1:131S-141S.
- Chen Y, et al. Hyperbaric oxygenation therapy promotes wound-healing in a murine model of hindlimb ischemia by suppressing inflammation and oxidative stress. J Trauma Acute Care Surg. 2018;84(1):142-151.
- Xu H, et al. Hyperbaric oxygen therapy suppresses NLRP3 inflammasome/caspase-1/IL-1β pathways in a rat model of multiple sclerosis. Brain Res. 2015;1627:12-20.
- Xu L, et al. Hyperbaric oxygen therapy ameliorates inflammation and oxidative stress in a rat model of Crohn’s disease. Med Gas Res. 2019;9(4):190-196.
- Lu X, et al. Hyperbaric oxygen therapy for type 2 diabetes mellitus: a randomized, controlled clinical trial. J Inflamm Res. 2019;12:107-116.
- Zhang R, et al. Hyperbaric oxygen therapy enhances the mobilization of bone marrow stem cells in rats with myocardial infarction. Cardiology. 2009;114(3):173-182.
- Li Y, et al. Hyperbaric oxygenation treatment promotes osteogenic differentiation of bone marrow stromal cells in vitro. Stem Cell Res Ther. 2018;9(1):274.
- Yang Y, et al. Hyperbaric oxygen preconditioning enhances the efficacy of mesenchymal stem cells in a rat model of acute myocardial infarction. Exp Ther Med. 2018;16(1):385-393.
- Wang L, et al. Hyperbaric oxygen promotes neural stem cell proliferation and differentiation in vitro. Stem Cell Res Ther. 2018;9(1):268.
- Zhang Y, et al. Hyperbaric oxygen therapy promotes angiogenesis in a rat model of hindlimb ischemia by upregulating VEGF. Biomed Res Int. 2015;2015:925428.
- Zhou Z, et al. Hyperbaric oxygen therapy enhances the expression of genes associated with angiogenesis and inflammation in patients with peripheral arterial disease. Med Gas Res. 2018;8(3):101-106.
- Zhang H, et al. Hyperbaric oxygen therapy improves the quality of life of patients with diabetes and chronic foot ulcers: a prospective randomized controlled clinical trial. Ostomy Wound Manage. 2020;66(3):16-25.
- https://pmc.ncbi.nlm.nih.gov/articles/PMC8432607/
- https://pmc.ncbi.nlm.nih.gov/articles/PMC8130666/
- https://www.mayoclinic.org/tests-procedures/hyperbaric-oxygen-therapy/about/pac-20394380
- https://www.uclahealth.org/medical-services/hyperbaric/indications
- https://ndafp.org/image/cache/David_Ajayi.pdf
- https://emedicine.medscape.com/article/1464149-overview?form=fpf
